TOKYO–(BUSINESS WIRE)–27 พฤศจิกายน 2023
Kirin Holdings Company, Limited (TOKYO:2503) และ Kao Corporation (TOKYO:4452) จะเข้าร่วมในการศึกษาเรื่องการส่งเสริมสุขภาพ Wakayama ซึ่งเป็นการศึกษาตามรุ่น*2 ซึ่งนำโดย Wakayama Medical University และจัดขึ้นโดย Health Promotion Research Center (HPRC) ซึ่งเป็นองค์กรไม่แสวงหาผลกำไร Kao และ Kirin Holdings ทำการศึกษาร่วมกันตั้งแต่เดือนพฤศจิกายน ปี 2022 เพื่อตรวจสอบความสัมพันธ์ระหว่างไขมันในอวัยวะภายในกับการทำงานของเซลล์พลาสมาไซตอยด์เดนไตรติก (pDC*3)*4 ซึ่งเป็นศูนย์ควบคุมการสร้างภูมิคุ้มกัน
ผลการวิจัยร่วม (สรุป) (กราฟิก: Business Wire)
ในช่วงปีที่ผ่านมา มีการมุ่งเน้นความสนใจไปที่ความสัมพันธ์ระหว่างโรคอ้วนและภูมิคุ้มกัน เนื่องจากมีรายงานว่า โรคอ้วนทำให้เกิดการติดเชื้อไวรัสที่รุนแรงมากขึ้น*5 การศึกษานี้เป็นการศึกษาครั้งแรกในญี่ปุ่น*1 เพื่อตรวจสอบความสัมพันธ์ระหว่างไขมันในอวัยวะภายในและการทำงานของคุ้มภูมิกัน และยืนยันว่าระดับไขมันในอวัยวะภายในสูงมีความสัมพันธ์กับการทำงานของ pDC ที่ต่ำ (การทำงานของภูมิคุ้มกันต่ำ) และระดับไขมันในอวัยวะภายในสูงและการทำงานของ pDC ต่ำมีความสัมพันธ์กับความเสี่ยงสูงต่อการติดเชื้อโคโรนาไวรัสและไข้หวัดใหญ่ การค้นพบนี้ยังไม่มีการรายงานในเอกสารใดๆ ในโลก*6 จะมีการแสดงผลลัพธ์ในการประชุมประจำปีครั้งที่ 44 ของสมาคมญี่ปุ่นเพื่อการศึกษาเรื่องโรคอ้วน และการประชุมประจำปีครั้งที่ 41 ของสมาคมญี่ปุ่นเพื่อการรักษาโรคอ้วน ซึ่งจะมีการจัดขึ้นในจังหวัดมิยางิ ในวันที่ 25 (เสาร์) และ 26 (อาทิตย์) เดือนพฤศจิกายน ปี 2023
*1 อ้างอิงจากบทความและข้อมูลบทคัดย่อที่ตีพิมพ์ใน Pubmed และ Journal of Health Care and Society Web (ณ วันที่ 22 เดือนพฤศจิกายน ปี 2023 ตามข้อมูลจาก KnowledgeWire)
*2 หนึ่งในวิธีการวิจัยเชิงสังเกตทางระบาดวิทยาเชิงวิเคราะห์ โดยการสร้างกลุ่มที่เกี่ยวข้องกับปัจจัยเฉพาะของโรคและกลุ่มที่ไม่เกี่ยวข้อง และการคำนวณอัตราอุบัติการณ์ของโรคเป้าหมายภายในแต่ละกลุ่ม ช่วยให้สามารถตรวจสอบความสัมพันธ์ระหว่างปัจจัยของโรคและการระบาดได้
*3 เซลล์ภูมิคุ้มกันที่มีบทบาทสำคัญในการควบคุมเมื่อมีแบคทีเรียหรือไวรัสเข้าสู่ร่างกาย การทำให้ pDC ทำงานจะช่วยกระตุ้นเซลล์ภูมิคุ้มกันต่างๆ เช่น เซลล์ NK ทีเซลล์ และบีเซลล์ เพื่อป้องกันการติดเชื้อไวรัส
*4 เปอร์เซ็นต์ของ pDC ที่สร้างปัจจัยต้านไวรัสตามการกระตุ้นที่เลียนแบบการติดเชื้อไวรัส
*5 Ghilotti F et al. J Epidemiol. 2019; 48(6): 1783-1794
Popkin BM et al. Obes Rev. 2020; 21(11): e13128
*6 อ้างอิงจากข้อมูลบทความที่ตีพิมพ์ใน Pubmed และ Journal of Health Care and Society Web (ณ วันที่ 22 เดือนพฤศจิกายน ปี 2023 ตามข้อมูลจาก KnowledgeWire)
ผลลัพธ์การวิจัยร่วม (บทสรุป)
การค้นพบครั้งแรกของญี่ปุ่น*1
(1) มีการค้นพบว่า การทำงานของ pDC จะลดลงในบุคคลที่มีไขมันในอวัยวะภายในสูง
(2) มีเปอร์เซ็นต์สูงที่ผู้มีไขมันในอวัยวะภายในสูงและการทำงานของ pDC ต่ำจะติดเชื้อไวรัสโคโรน่าสายพันธุ์ใหม่และไข้หวัดใหญ่ เมื่อเทียบกับผู้ที่ไม่มีไขมันในอวัยวะภายในสูง
ผลกระทบที่ได้รับ
ขอแนะนำว่า การรักษามวลไขมันในอวัยวะภายในต่ำและการทำงานของ pDC สูงนั้น มีความสัมพันธ์กับการลดความเสี่ยงในการติดเชื้อโคโรนาไวรัสและไข้หวัดใหญ่
ผลการวิจัยร่วม
– ความเป็นมาและวัตถุประสงค์
มีการระบุโรคอ้วนโดยองค์การอนามัยโลก (WHO) ว่า เป็น “ภาวะที่มีความเสี่ยงต่อสุขภาพที่เพิ่มขึ้น เนื่องจากมีการสะสมไขมันที่ผิดปกติหรือมากเกินไป” และมีความสัมพันธ์กับความเสี่ยงที่เพิ่มขึ้นของการเกิดโรคเรื้อรัง มีการศึกษาผลกระทบจากโรคอ้วนที่มีต่อสุขภาพในหลายประเทศ ในช่วงไม่กี่ปีที่ผ่านมา ความสัมพันธ์ระหว่างโรคอ้วนและภูมิคุ้มกันได้รับความสนใจ เนื่องจากมีการรายงานว่า โรคอ้วนนำไปสู่การติดเชื้อไวรัสที่รุนแรงยิ่งขึ้น*7
การวิจัยนี้จัดทำขึ้นโดยเป็นส่วนหนึ่งของการศึกษาวิจัยเรื่องการส่งเสริมสุขภาพ Wakayama โดยมีการตั้งเป้าไปที่ผู้อยู่อาศัยใน Wakayama มาตั้งแต่ปี 2011 Kao ซึ่งมีส่วนเกี่ยวข้องกับการวิจัยเรื่องโรคอ้วนจากไขมันในอวัยวะภายใน ซึ่งถือว่ามีความเกี่ยวข้องอย่างใกล้ชิดกับโรคที่เกี่ยวข้องกับวิถีชีวิต และ Kirin Holdings ซึ่งมีการวิจัยในสาขาภูมิคุ้มกันวิทยามานานกว่า 35 ปี ได้ร่วมมือกันเพื่อชี้แจงความสัมพันธ์ระหว่างไขมันในอวัยวะภายในและการทำงานของ pDC
*7 Pranata R et al. Clin Nutr ESPEN. 2021; 43: 163-168
– การศึกษาเรื่องการส่งเสริมสุขภาพ Wakayama คืออะไร
นี่เป็นการศึกษาตามรุ่นที่นำโดย Wakayama Medical University ตั้งแต่ปี 2011 ซึ่งปัจจุบันกำลังดำเนินการร่วมกับ HPRC เพื่อระบุปัจจัยทางพันธุกรรมและสิ่งแวดล้อมที่เกี่ยวข้องกับการพัฒนาของโรคต่างๆ ในหมู่ประชากรที่อาศัยอยู่ใน Wakayama
ในปัจจุบัน มีการวิจัยที่ดำเนินการในโครงการเกี่ยวกับวิถีชีวิต โรคที่เกี่ยวข้องกับวิถีชีวิต และมวลกล้ามเนื้อ ส่งผลให้เกิดการค้นพบมากมาย รวมถึงความสัมพันธ์ระหว่างการสูญเสียมวลกล้ามเนื้อและการพัฒนาของหลอดเลือด และความสัมพันธ์ระหว่างประวัติในการหกล้อมและการทำงานด้านกายภาพโดยสมัครใจ นี่เป็นครั้งแรกที่โครงการทำการวิจัยเกี่ยวกับการทำงานของระบบภูมิคุ้มกัน
Kirin Holdings และ Kao ดำเนินงานร่วมกันเพื่อพิสูจน์ความสัมพันธ์ระหว่างมวลไขมันในอวัยวะภายในและการทำงานของ pDC ในการศึกษาการส่งเสริมสุขภาพใน Wakayama เพื่อลดความเสี่ยงต่อสุขภาพของผู้บริโภคในอนาคต
– วิธีการวิจัย
ในเดือนพฤศจิกายน ปี 2022 มีการจัดการตรวจสุขภาพเฉพาะสำหรับ Wakayama ที่มีผู้อยู่อาศัย 223 คน ช่วงอายุ 50–55 ปี จากการดำเนินการนี้ ช่วยให้ Kao ได้รับข้อมูลเกี่ยวกับพฤติกรรมตามวิถีชีวิตและบริเวณไขมันในอวัยวะภายใน ในขณะที่ Kirin มีการวัดข้อมูลจากการทำงานของ pDC ในเลือด จะมีการแบ่งปันข้อมูลเหล่านี้ระหว่างทั้งสองทีม และมีการศึกษาและวิเคราะห์ร่วมกันเกี่ยวกับความสัมพันธ์ระหว่างไขมันในอวัยวะภายในและการทำงานของ pDC มีการแบ่งกลุ่มที่ศึกษาออกเป็นดังนี้
บริเวณไขมันในอวัยวะภายใน: จากค่ามัธยฐานที่ 77 ซม.2 สำหรับค่าทั้งหมด จะมีการกำหนดให้ระดับไขมันในอวัยวะภายในที่น้อยกว่า 77 ซม.2 ให้เป็นกลุ่มไขมันในอวัยวะภายในต่ำ และกลุ่มที่มีระดับไขมันในอวัยวะภายในสูงกว่า 77 ซม.2 จะถือว่าเป็นกลุ่มไขมันในอวัยวะภายในสูง
การทำงานของ pDC: ขึ้นอยู่กับค่ามัธยฐานที่ 9.52% สำหรับค่าทั้งหมด จะมีการกำหนดให้กลุ่มที่มีการทำงานของ pDC อยู่ที่ 9.52% หรือน้อยกว่าเป็นกลุ่มที่มีการทำงานของ pDC ต่ำ และกลุ่มที่มีการทำงานของ pDC อยู่ที่ 9.52% หรือสูงกว่าเป็นกลุ่มที่มีการทำงานของ pDC สูง
– ผลลัพธ์
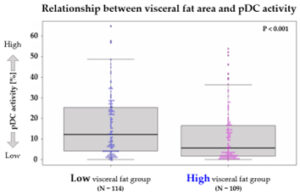
ผลลัพธ์ที่ 1: ความสัมพันธ์ระหว่างบริเวณไขมันในอวัยวะภายในและการทำงานของ pDC
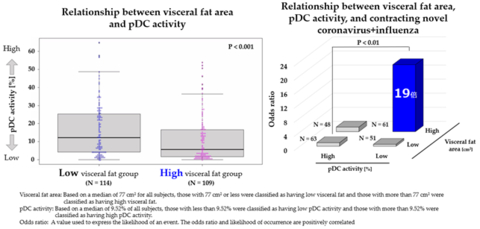
กลุ่มที่มีค่าบริเวณไขมันในอวัยวะภายในสูงจะมีการทำงานของ pDC ต่ำกว่ากลุ่มที่มีค่าบริเวณไขมันในอวัยวะภายในต่ำอย่างมีนัยสำคัญ (ภาพที่ 1)
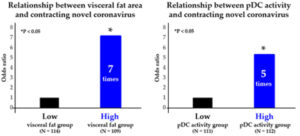
ผลลัพธ์ที่ 2: ผลกระทบของบริเวณไขมันในอวัยวะภายในและการทำงานของ pDC ต่อการติดโรคติดเชื้อ
กลุ่มที่มีค่าบริเวณไขมันในอวัยวะภายในสูงมีอุบัติการณ์ในการติดเชื้อโคโรนาไวรัสสายพันธุ์ใหม่สูงกว่ากลุ่มที่มีค่าต่ำ โดยมีอัตราส่วนโอกาสที่จะเกิดขึ้นสูงถึง 7 เท่า*8 ในขณะเดียวกัน กลุ่มที่มีการทำงานของ pDC ต่ำมีอุบัติการณ์ในการติดเชื้อโคโรนาไวรัสสายพันธุ์ใหม่สูงกว่ากลุ่มที่มีการทำงานของ pDC สูง โดยมีอัตราส่วนโอกาสที่จะเกิดขึ้นสูงถึง 5 เท่า (ภาพที่ 2)
ยังมีการแบ่งการวิเคราะห์ออกเป็นสี่กลุ่ม เพื่อยืนยันผลเสริมฤทธิ์สำหรับบริเวณไขมันในอวัยวะภายในสูงหรือต่ำ และการทำงานของ pDC และพบว่า กลุ่มที่มีบริเวณไขมันในอวัยวะภายในสูงและการทำงานของ pDC ต่ำ มีอุบัติการณ์ในการติดเชื้อไวรัสโคโรนนาสายพันธุ์ใหม่สูงกว่ากลุ่มที่มีบริเวณไขมันอวัยวะภายในต่ำและการทำงานของ pDC สูง โดยมีอัตราส่วนโอกาสที่จะเกิดขึ้นสูงถึง 20 เท่า และมีการตรวจพบผลลัพธ์เช่นเดียวกันสำหรับไข้หวัดใหญ่ (ภาพที่ 3)
*8 อัตราส่วนโอกาสที่จะเกิดขึ้นเป็นค่าที่ใช้เพื่อแสดงความเป็นไปได้ที่จะเกิดเหตุการณ์ขึ้น อัตราส่วนโอกาสที่จะเหิดขึ้นและความน่าจะเป็นที่จะเกิดขึ้นมีความสัมพันธ์เชิงบวก
– ผลการวิจัยเกี่ยวกับการทำงานร่วมกัน
นับเป็นครั้งแรกในโลกที่การทำงานร่วมกันนี้ มีการวิจัยพบว่า ผู้ที่มีระดับบริเวณไขมันในอวัยวะภายในสูงมีการทำงานของ pDC ต่ำ นอกจากนี้ ยังมีการแนะนำว่า บริเวณไขมันในอวัยวะภายในและการทำงานของ pDC ตามลำดับ ส่งผลต่อความไวในการติดเชื้อโคโรนาไวรัสและไข้หวัดใหญ่ และผู้ที่มีบริเวณไขมันอวัยวะภายในสูงและการทำงานของ pDC ต่ำ จะมีความเสี่ยงต่อโรคเหล่านี้เป็นพิเศษ
ดังนั้น จึงอาจกล่าวได้ว่า เป็นสิ่งสำคัญสำหรับผู้ที่มีค่าบริเวณไขมันในอวัยวะภายในสูงและการทำงานของ pDC ต่ำเพื่อการจัดการมวลไขมันในอวัยวะภายในและการทำงานของระบบภูมิคุ้มกัน
เกี่ยวกับ Kirin Holdings
Kirin Holdings Company, Limited เป็นบริษัทระดับโลกที่ดำเนินงานในภาคส่วนอาหารและเครื่องดื่ม (ธุรกิจอาหารและเครื่องดื่ม) ภาคส่วนเภสัชกรรม (ธุรกิจเภสัชกรรม) และภาคส่วนวิทยาศาสตร์สุขภาพ (ธุรกิจวิทยาศาสตร์สุขภาพ) ทั้งในญี่ปุ่นและทั่วโลก
Kirin Holdings มีรากฐานมาจาก Japan Brewery ซึ่งก่อตั้งขึ้นในปี 1885 Japan Brewery ได้เปลี่ยนเป็น Kirin Brewery ในปี 1907 นับตั้งแต่นั้นเป็นต้นมา บริษัทได้ขยายธุรกิจเกี่ยวกับการหมักและเทคโนโลยีชีวภาพเป็นเทคโนโลยีหลัก และเข้าสู่ธุรกิจเภสัชกรรมในปี 1980 โดยยังคงเป็นศูนย์กลางระดับโลกที่ยังคงเติบโตอยู่ ในปี 2007 Kirin Holdings ก่อตั้งขึ้นเป็นบริษัทโฮลดิ้ง และปัจจุบันมุ่งเน้นไปที่การขยายขอบเขตภาคส่วนวิทยาสาสตร์สุขภาพ
ภายใต้วิสัยทัศน์ Kirin Group Vision 2027 (KV 2027) ซึ่งเป็นแผนการบริหารระยะยาวที่เปิดตัวในปี 2019 Kirin Group ตั้งเป้าที่จะเป็นผู้นำระดับโลกในด้าน CSV*9 เพื่อสร้างมูลค่าในโลกของอาหารและเครื่องดื่มไปจนถึงภาคส่วนเภสัชกรรม นับจากนี้ไป Kirin Group จะยังคงใช้ประโยชน์จากจุดแข็งของตนเพื่อสร้างมูลค่าทั้งทางสังคมและเศรษฐกิจผ่านธุรกิจ โดยมีเป้าหมายเพื่อให้บรรลุการเติบโตที่ยั่งยืนในคุณค่าขององค์กร
*9 การสร้างคุณค่าร่วมกัน: มูลค่าเพิ่มร่วมกันสำหรับผู้บริโภคและสังคมโดยรวม
เกี่ยวกับ Kao Corporation
Kao สร้างสรรค์ผลิตภัณฑ์และบริการที่มีมูลค่าเพิ่มสูง ซึ่งนำเสนอการดูแลและเติมเต็มให้กับชีวิตของผู้คนทั้งหมดและโลกใบนี้ Kao เป็นส่วนหนึ่งของชีวิตประจำวันของผู้คนในเอเชีย โอเชียเนีย อเมริกาเหนือ และยุโรป ผ่านผลงานของแบรนด์ชั้นนำกว่า 20 แบรนด์ เช่น Attack, Bioré, Goldwell, Jergens, John Frieda, Kanebo, Laurier, Merries, และ Molton Brown เมื่อมีการรวมเข้ากับธุรกิจเคมีภัณฑ์ ซึ่งมีส่วนช่วยในอุตสาหกรรมต่างๆ มากมาย Kao สร้างรายได้ประมาณ 1,420 พันล้านเยนจากยอดขายต่อปี Kao มีพนักงานประมาณ 33,500 คนทั่วโลก และมีประวัติศาสตร์ยาวนานถึง 135 ปีในด้านนวัตกรรม โปรดเข้าชมข้อมูลที่อัปเดตในเว็บไซต์ของ Kao Group https://www.kao.com/global/en/
Kao มีการก่อตั้งกลยุทธ์ ESG คือ Kirei Lifestyle Plan ในเดือนเมษายน ปี 2019 ตั้งแต่ปี 2021 Kao มีการส่งเสริมแผนระยะกลางตาม “การปกป้องขีวิตในอนาคต” และส่งเสริม “ความยั่งยืนเป็นหลัก” เป็นวิสัยทัศน์ Kao จะยังคงบูรณาการมุมมอง ESG เข้ากับการบริหารจัดการบริษัท โดยมีเป้าหมายที่จะพัฒนาธุรกิจและจัดหาผลิตภัณฑ์และบริการที่ดียิ่งขึ้นแก่ผู้บริโภคและสังคม และทำงานตามจุดประสงค์ “เพื่อสร้างโลก Kirei เพื่อทุกชีวิตสามารถอยู่ร่วมกันได้อย่างกลมกลืน”
สามารถรับชมภาพในรูปแบบมัลติมีเดียได้ที่:
https://www.businesswire.com/news/home/53862302/en
เนื้อหาใจความในภาษาต้นฉบับของข่าวประชาสัมพันธ์ฉบับนี้เป็นฉบับที่เชื่อถือได้และเป็นทางการ การแปลต้นฉบับนี้จึงมีจุดประสงค์เพื่ออำนวยความสะดวกเท่านั้น และควรนำไปเทียบเคียงอ้างอิงกับเนื้อหาในภาษาต้นฉบับ ซึ่งเป็นฉบับเดียวที่มีผลทางกฎหมาย
ติดต่อ
ผู้ติดต่อสำหรับสื่อ
Corporate Communication Department
Kirin Holdings Company, Limited
Nakano Central Park South, 4-10-2 Nakano, Nakano-ku, Tokyo
https://www.kirinholdings.com/en/
kirin-cc@kirin.co.jp
Corporate PR, Corporate Strategy
Kao Corporation
1-14-10, Nihonbashi Kayabacho, Chuo-ku, Tokyo
https://www.kao.com/global/en/
corporate_pr@kao.com
แหล่งข้อมูล: Kirin Holdings Company, Limited